„Hauptberuflich sind Mitochondrien die Knotenpunkte des Stoffwechsels und der Energieumwandlung“, erläutert Studienleiter Prof. Dr. Markus Schwarzländer vom IBBP der WWU. „Überraschend ist nun, dass sie offenbar auch überschüssige reduzierte Schwefelverbindungen, sogenannte Thiole, unschädlich machen können, die ansonsten an anderen Orten der Zelle zu Schäden führen könnten.“ Dazu werde ein besonderes Krisenprogramm ausgelöst, der ‚ANAC017 Signalweg‘. „Das Protein ‚Alternative Oxidase‘ sorgt dann für eine höhere Atmungskapazität der Mitochondrien in Pflanzen.“ Dieser Vorgang war vor einigen Jahren von einer australischen und einer belgischen Arbeitsgruppe entdeckt worden. Neu ist die Erkenntnis, dass er durch reduktiven Stress ausgelöst werden und dem Schutz der Proteinfaltung im Endoplasmatischen Retikulum (ER) dienen kann – also dem Exportsystem für Proteine in der Zelle.
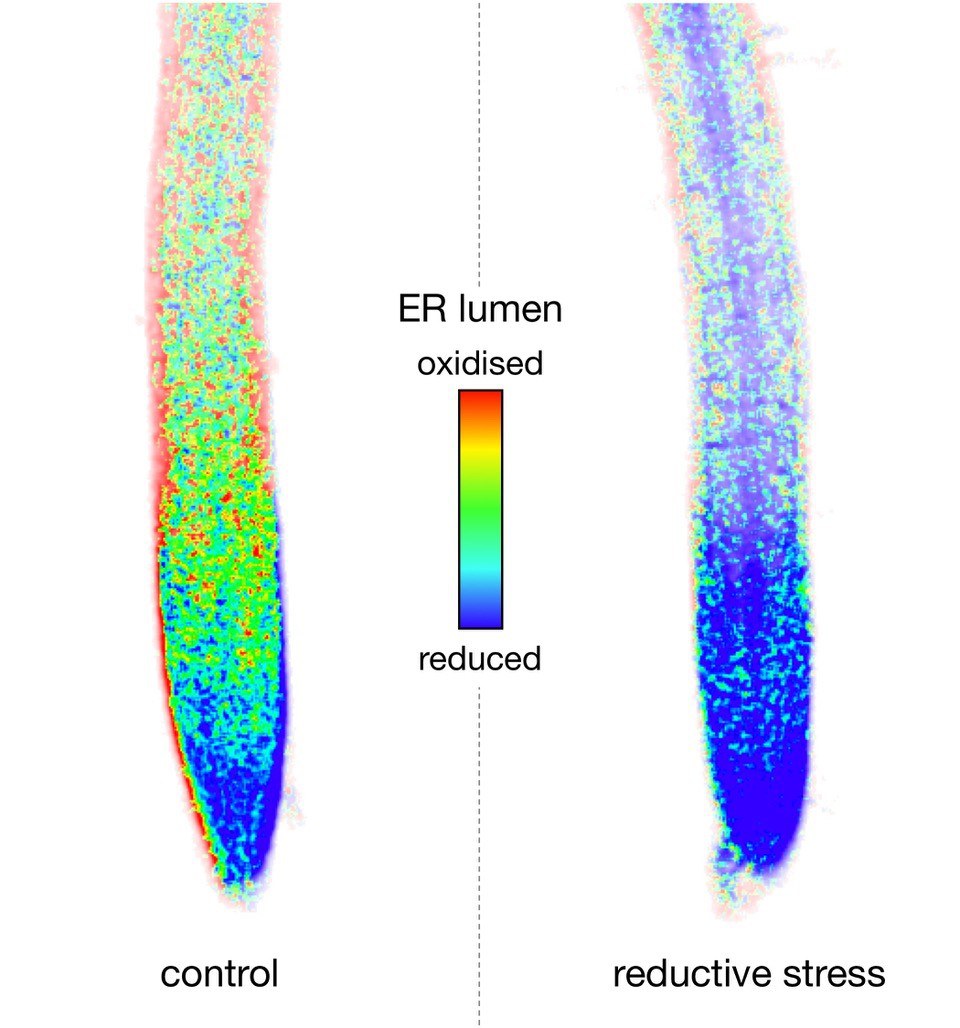
„Das Endoplasmatische Retikulum ist ein Kompartiment, in dem Proteine mit Unterstützung eines spezifischen Oxidationssystems gefaltet und für den Export aus der Zelle oder die Speicherung vorbereitet werden“, sagt Prof. Dr. Andreas Meyer vom Institut für Nutzpflanzenwissenschaften und Ressourcenschutz (INRES), der auch Mitglied im Transdisziplinären Forschungsbereich „Sustainable Futures“ der Universität Bonn ist. „Reduktiver Stress führt durch ein Übermaß an niedermolekularen Thiolen zu einer Störung der oxidativen Proteinfaltung.“
Ebenfalls neu und unerwartet ist laut der aktuellen Studie, dass es den Mitochondrien gelingt, Thiole mit hoher Rate zu veratmen. „Das widerspricht der gängigen Lehrmeinung“, räumt Markus Schwarzländer ein. „Deshalb haben wir mehrere unterschiedliche Methoden eingesetzt, um die Beobachtungen unabhängig zu validieren und mögliche Fehler auszuschließen.“ So habe das Team eine neue Methode optimiert, um die Energetisierung von Mitochondrien dynamisch zu untersuchen.
„Dass die Zellatmung in den Mitochondrien Stoffe oxidieren kann und dies gekoppelt an die Umwandlung von Energie ständig tut, zählt zu den herausragenden Erkenntnissen der Biowissenschaften des vergangenen Jahrhunderts“, unterstreicht der Wissenschaftler. Auch dass Mitochondrien in Pflanzen besonders flexibel sind und besondere Mechanismen besitzen, um Prozesse in anderen Zellorganellen zu unterstützen, sei seit vielen Jahren bekannt. „Die aktuelle Studie erweitert aber unser Verständnis von dieser Flexibilität entscheidend.“
Das Konzept der Zusammenarbeit von Endoplasmatischem Retikulum und Mitochondrien bei reduktivem Stress sei kürzlich von Arbeiten in Hefe und tierischen Zellen aufgeworfen worden. „Besonders überraschend war nun die Beobachtung, dass Thiole tatsächlich in hoher Rate von pflanzlichen Mitochondrien veratmet und zur Energietransformation genutzt werden können – entweder direkt oder über eine Art ‚metabolischen Bypass‘, den es nun weiter zu untersuchen gilt“, sagt Schwarzländer. Den Mitochondrien komme damit in der Zelle eine unerwartete neue Funktion als ‚Schutzpatrone‘ der Proteinfaltung im Endoplasmatischen Retikulum zu. Sie wird den Wissenschaftlern zufolge je nach Bedarf von der Zelle reguliert.
Hintergrund:
Alles Leben besteht aus Zellen. Alle Zellen benötigen Proteine, die sehr präzise gefaltet werden müssen, damit sie ihre Funktion erfüllen können. Die Proteine, die von Tieren, Pilzen und Pflanzen sekretiert, also aus der Zelle herausgeschleust werden, oder an ihrer Oberfläche zur Umweltinteraktion beitragen, müssen dabei mithilfe sogenannter Disulfidbrücken stabilisiert werden. Ein Beispiel beim Menschen ist das bekannte Insulin. Generell funktionieren aber unzählige lebenswichtige Rezeptor- und Signalproteine nur mit korrekten Verknüpfungen über Disulfidbrücken. Diese werden in einem ganz bestimmten Ort der Zelle, dem sogenannten Endoplasmatischen Retikulum (ER) geknüpft. Dazu werden Schwefelatome von je zwei Thiolgruppen der Aminosäure Cystein im Inneren des ER oxidiert und kovalent miteinander verbunden.
Steigt aber der Bedarf an Disulfidbrücken plötzlich an oder werden sie durch einen Stressfaktor oder bestimmte chemische Substanzen aufgebrochen, ist das für die Zelle problematisch. Falsch gefaltete Proteine können großen Schaden verursachen – bis hin zum Tod. Daher reagiert die Zelle mit speziellen Krisenprogrammen. Diese gut untersuchten Programme unterstützen die Proteinfaltung im Inneren des ER, indem sie etwa für zusätzliche Kapazität in der Oxidationsmaschinerie sorgen. Neu ist nun die Erkenntnis, dass im Krisenfall das ER überraschend Unterstützung aus einem anderen Bereich der Zelle erhält.
Beteiligte Institutionen:
Alle Arbeiten wurden an den Universitäten Münster und Bonn durchgeführt. Das Projekt wurde in einem DFG-Graduiertenkolleg in Bonn begonnen und nach dem Umzug der Arbeitsgruppe Schwarzländer nach Münster 2017 in Bonn und Münster weitergeführt. Mittlerweile sind einige der Co-Autoren an anderen Institutionen tätig, zum Beispiel am Max-Planck-Institut in Köln, der TU Kaiserslautern und der Universität Mailand. Der Erstautor Philippe Fuchs ist inzwischen im nachhaltigen Pflanzenschutz in einem Unternehmen in der Schweiz tätig, war aber für die Arbeit von Beginn bis hin zur Publikation maßgeblich.
Förderung:
Die Studie wurde von der Deutschen Forschungsgemeinschaft (DFG) gefördert.
Publikation: P. Fuchs, F. Bohle, S. Lichtenauer, J.M. Ugalde, E. Feitosa Araujo, B. Mansuroglu, C. Ruberti, S. Wagner, S. J. Müller-Schüssele, A. J. Meyer & M. Schwarzländer: Reductive stress triggers NAC17-mediated retrograde signaling to safeguard the ER by boosting mitochondrial respiratory capacity. Plant Cell. accepted, https://doi.org/10.1093/plcell/koac017